 A flexibilidade estrutural de uma macromolécula é fundamental para sua função, seja dentro de uma célula no caso de uma proteína, seja em um novo material sintético.
A flexibilidade estrutural de uma macromolécula é fundamental para sua função, seja dentro de uma célula no caso de uma proteína, seja em um novo material sintético.
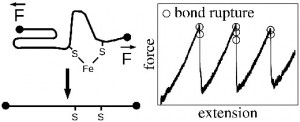
Técnicas espectroscópicas de manipulção ‘single-molecule’, como microscopia de força atômica (AFM), permitem que a estabilidade mecânica de proteínas e de até ligações covalentes individuais sejam estudadas com grande precisão.
Nos interessamos em compreender os detalhes microscópicos de tais experimentos e a reatividade química induzida em metaloproteínas desenoveladas mecanicamente. Este conhecimento poderá ser usado para otimizar a estabilidade de proteínas naturais ou desenhadas artificialmente.
Veja alguns de nossos artigos nesta área:
- Combining free energy simulations and NMR chemical-shift perturbation to identify transient cation-pi contacts in proteins. Reis AAO, Sayegh RSR, Marana SR e Arantes GM. J. Chem. Inf. Model., 60, 890-897, 2020;
- Mechanical unfolding of macromolecules coupled to bond dissociation. Nunes-Alves A, Arantes GM, J. Chem. Theory Comput., 14, 282-290, 2018;
- Force-induced chemical reactions on the metal centre in a single metalloprotein molecule. Zheng P, Arantes GM, Field MJ e Li H, Nat. Commun., 6:7569, 2015;





